
Tartalomjegyzék:
- Szerző John Day [email protected].
- Public 2024-01-30 09:41.
- Utoljára módosítva 2025-01-23 14:48.




Helló!
A folyadékok vagy más tárgyak azért tűnnek színesnek, mert bizonyos színeket tükröznek vagy továbbítanak, másokat pedig lenyelnek (elnyelnek). Egy úgynevezett fotométerrel meg lehet határozni azokat a színeket (hullámhosszakat), amelyeket a folyadékok elnyelnek. Az alapelv egyszerű: egy bizonyos színű LED -del először átvilágít egy vízzel vagy más oldószerrel töltött küvettán. Egy fotodióda méri a bejövő fényintenzitást, és U0 arányos feszültséggé alakítja át. Ez az érték fel van tüntetve. Ezt követően a vizsgálandó folyadékot tartalmazó küvettát a sugárútba helyezzük, és ismét megmérjük a fényintenzitást vagy az U feszültséget. A százalékos átviteli tényezőt ezután egyszerűen kiszámítjuk T = U / U0 * 100 értékkel. Az abszorpciós tényező meghatározásához A csak ki kell számolnia A = 100 mínusz T.
Ez a mérés megismétlődik különböző színű LED -ekkel, és minden esetben meghatározza T vagy A hullámhossz (szín) függvényében. Ha ezt elegendő LED -del teszi, akkor abszorpciós görbét kap.
1. lépés: Az alkatrészek



A fotométerhez a következő alkatrészekre van szüksége:
* 160 x 100 x 70 mm vagy hasonló méretű fekete tok: ház
* Egy Arduino Nano: ebay arduino nano
* LF356 operációs erősítő: ebay LF356
* 3 db 10μF kapacitású kondenzátor: ebay kondenzátorok
* 2 C = 100 nF kondenzátor és 1 nF kondenzátor: ebay kondenzátorok
* Egy feszültségű inverter ICL7660: ebay ICL7660
* Egy BPW34 fotodióda: az ebay BPW34 fotodiódája
* 6 ellenállás 100, 1k, 10k, 100k, 1M és 10M ohmokkal: ebay ellenállások
* I²C 16x2 kijelző: ebay 16x2 kijelző
* 2x6 forgó kapcsoló: forgókapcsoló
* 9V elemtartó és 9V elem: elemtartó
* egy kapcsoló: kapcsoló
* Üveg küvetták: ebay küvetták
* Különböző színű LED -ek: pl. ebay LED -ek
* egyszerű 0-15V-os tápegység a LED-ek táplálására
* fa a küvettatartó számára
2. lépés: Az áramkör és az Arduino-kód


A fotométer áramköre nagyon egyszerű. Ez egy fotodiódából, egy operációs erősítőből, egy feszültség-inverterből és néhány más részből áll (ellenállások, kapcsolók, kondenzátorok). Az ilyen típusú áramkör elve az, hogy a fotodióda (alacsony) áramát magasabb feszültséggé alakítja át, amelyet az arduino nano leolvashat. A szorzótényezőt az ellenállás értéke határozza meg az OPA visszacsatolásában. A rugalmasság érdekében 6 különböző ellenállást vettem, amelyeket a forgókapcsolóval lehet választani. A legalacsonyabb "nagyítás" 100, a legnagyobb 10 000 000. Mindent egyetlen 9 V -os elem táplál.
3. lépés: Első kísérlet: a klorofill abszorpciós görbéje




A mérési eljáráshoz: A küvettát vízzel vagy átlátszó oldószerrel kell megtölteni. Ezt a fotométerbe helyezzük. A küvettát fényzáró fedél borítja. Most állítsa be a LED tápellátását úgy, hogy körülbelül 10-20 mA áram folyjon át a LED-en. Ezt követően a forgókapcsolóval válassza ki azt a pozíciót, ahol a fotodióda kimeneti feszültsége 3-4 V körül van. A kimeneti feszültség finomhangolása továbbra is elvégezhető az állítható tápegységgel. Ezt az U0 feszültséget jegyezzük fel. Ezután vegye ki a vizsgálandó folyadékot tartalmazó küvettát, és helyezze a fotométerbe. Ekkor a tápfeszültségnek és a forgókapcsoló helyzetének változatlannak kell maradnia! Ezután fedje le ismét a küvettát a fedéllel, és mérje meg az U feszültséget. A T átvitel százalékában az érték T = U / U0 * 100. Az A abszorpciós együttható eléréséhez csak ki kell számítani az A = 100 - T értéket.
A különböző színű LED -eket a Roithner Lasertechnik -től vásároltam, amely Ausztriában, hazámban található. Ezekhez a megfelelő hullámhosszot nanométerben adjuk meg. Annak érdekében, hogy valóban meggyőződhessünk arról, hogy spektroszkóppal és a Theremino szoftverrel (theremino spektrométer) ellenőrizhetjük az uralkodó hullámhosszat. Az én esetemben az adatok nm -ben teljesen egyeztek a mérésekkel. A LED -ek kiválasztásakor egyenletes lefedettséget kell elérnie a 395 nm és 850 nm közötti hullámhossztartományban.
A fotométerrel végzett első kísérlethez a klorofillt választottam. De ehhez füvet kell szednie egy rétről, remélve, hogy senki sem figyel rád…
Ezt a füvet ezután apró darabokra vágják, és propanollal vagy etanollal együtt egy edénybe teszik. Most mozsárral vagy villával összetöri a leveleket. Néhány perc múlva a klorofill szépen feloldódott a propanolban. Ez a megoldás még mindig túl erős. Meg kell hígítani elegendő propanollal. A szuszpendálás elkerülése érdekében az oldatot szűrni kell. Vettem egy közös kávészűrőt.
Az eredménynek a képen láthatónak kell lennie. Nagyon áttetsző zöld-sárgás oldat. Ezután ismételje meg a mérést (U0, U) minden LED -del. Amint az a kapott abszorpciós görbéből is látható, az elmélet és a mérés egészen jól megegyezik. A klorofill a + b nagyon erősen szívódik fel a kék és a vörös spektrális tartományban, míg a zöld-sárga és az infravörös fény szinte akadálytalanul behatol az oldatba. Az infravörös tartományban az abszorpció még a nulla közelében is van.
4. lépés: Második kísérlet: A kihalás függősége a kálium -permanganát koncentrációjától




További kísérletként az extinkció meghatározása az oldott anyag koncentrációjától függ. Oldott anyagként kálium -permanganátot használok. A fényintenzitás az oldatba való behatolás után a Lambert-Beer törvényt követi: I = I0 * 10 ^ (- E). I0 az intenzitás oldott anyag nélkül, I az intenzitás oldott anyaggal és E az úgynevezett kioltás. Ez az E kioltás (lineárisan) függ a küvettának x vastagságától és az oldott anyag c koncentrációjától. Így E = k * c * x, k pedig a moláris abszorpciós együttható. Az E kihalás meghatározásához csak I és I0 szükséges, mert E = lg (I0 / I). Ha az intenzitást például 10%-ra csökkentjük, az extinkció E = 1 (10 ^ -1). Csak 1%-os gyengüléssel E = 2 (10 ^ -2).
Ha az E -t alkalmazzuk a c koncentráció függvényében, akkor azt várjuk, hogy emelkedő egyenest kapunk a nulla ponton keresztül.
Amint a kihalási görbémből látható, ez nem lineáris. Magasabb koncentrációknál ellaposodik, különösen a 0,25 -nél nagyobb koncentrációtól. Ez azt jelenti, hogy a kihalás alacsonyabb, mint a Lambert-Beer törvény szerint várható lenne. Ha azonban csak az alacsonyabb koncentrációkat vesszük figyelembe, például 0 és 0,25 között, nagyon szép lineáris összefüggést eredményez a c koncentráció és az E kihalás között. Ebben a tartományban az ismeretlen c koncentráció meghatározható a mért E kihalásból., a koncentrációnak csak tetszőleges egységei vannak, mivel nem határoztam meg az oldott kálium-permanganát kezdeti mennyiségét (ez csak milligramm volt, amit az én konyhai skálámmal nem tudtam mérni, 4 ml vízben oldva megoldás).
5. lépés: Következtetések

Ez a fotométer különösen alkalmas fizika és kémia órákra. A teljes költség csak körülbelül 60 Euro = 70 USD. A különböző színű LED -ek a legdrágább alkatrészek. Az ebay -en vagy az aliexpress -en biztosan talál olcsóbb LED -eket, de általában nem tudja, milyen hullámhosszúak a LED -ek. Így nézve ajánlott szakkereskedőtől vásárolni.
Ebben a leckében megtudhat valamit a folyadékok színe és azok abszorpciós viselkedése közötti összefüggésről, a fontos klorofillről, a Lambert-Beer törvényről, az exponenciális értékekről, az átvitelről és az abszorpcióról, a százalékok számításáról és a látható színek hullámhosszáról. Szerintem ez elég sok…
Szóval jó szórakozást a projekt elkészítéséhez a leckében és Eureka!
Végül, de nem utolsósorban nagyon örülnék, ha szavazhatna rám az osztályterem-tudomány-versenyen. Köszönet érte…
Ha pedig további fizikai kísérletek érdekelnek, itt a youtube csatornám:
www.youtube.com/user/stopperl16/videos?
további fizikai projektek:
Ajánlott:
Matematika-fizika szivárvány óra: 3 lépés (képekkel)
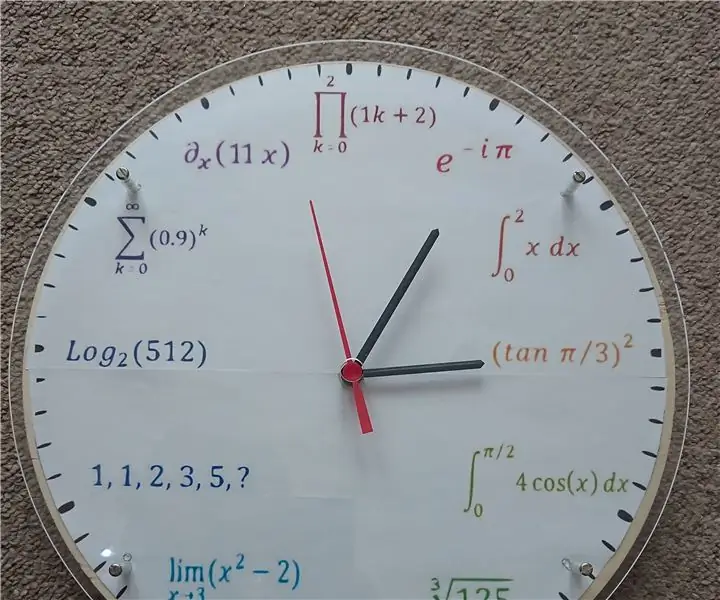
Matematika-fizika szivárványos óra: Egy ideje volt egy ötletem, hogy saját fizika/matematika órát készítsek, ezért elkezdtem tervezni az Inkscape-ben. Minden órában, 1 -től 12 -ig fizika/matematika képlettel helyettesítettem: 1 - Euler -egyenlet2 - Integrál 3 - Trigonometrikus függvény4 - A trigonom integrálja
Arduino Ws2812 LED vagy Neopixel LED szalag vagy gyűrű bemutató: 4 lépés

Arduino Ws2812 LED vagy Neopixel LED csík vagy gyűrű bemutató: Ebben az oktatóanyagban megtanuljuk, hogyan kell használni a neopixelt vagy a ws 2812 -et vagy a gyors ledet az Arduino -val. Az ilyen típusú LED -eket, szalagokat vagy gyűrűket egyetlen Vin csap és az összes A LED -ek egyedileg címezhetők, ezért ezeket indikátoroknak is nevezik
Kültéri, időjárásálló lámpatest Lifx vagy Hue számára: 5 lépés (képekkel)

Kültéri, időjárásálló lámpatest Lifx vagy Hue színekhez: Meg akartam világítani a kertemet a Lifx Color 1000 izzóimmal, az esti élvezethez, valamint az alkalmi háztáji tomboláshoz. Tekintettel az izzók sebezhetőségére a nedvességgel és a hővel szemben, nem találtam olyan szerelvényt a piacon, amely megfelelően megvédené a t
Arduino alapú távirányító Eskate vagy szárnyashajó számára: 5 lépés (képekkel)

Arduino alapú távirányító Eskate vagy szárnyashajó számára: Ez az oktatóanyag bemutatja, hogyan kell fizikai távirányítót készíteni egy eskate vagy egy elektromos szárnyashajóhoz, beleértve az összes szükséges kódot és hardvert. Sok forrasztás van benne, de az elkészítése is szórakoztató. Mit tehet a távirányító? Együtt
"MicroDot" a LattePanda (vagy a Raspberry Pi) számára: 7 lépés (képekkel)

"MicroDot" a LattePanda (vagy Raspberry Pi) számára: A MicroDot egy házi készítésű Alexa "gomb", amelyet úgy terveztek, hogy csatlakozzon egy LattePanda vagy Raspberry Pi készülékhez, és telepítve van az Alexa Sample App. Ez egy kisméretű hangszóró LED -ekkel és érintés/beszéd aktiválással, és ideális asztali vagy autós használatra. *Az
